Bohrsches Atommodell - Herleitung der Energieformel
Im Folgenden möchten wir eine Formel zur Berechnung der Energie, vom Radius und der Geschwindigkeit aus bereits bekannten Formeln in Kombination mit den Bohrschen Postulaten herleiten.
Die Energie, die ein Elektron auf einer Bahn besitzt setzt sich aus zwei Teilen, der potentiellen und kinetischen Energie zusammen:
\[E_{Ges}=E_{kh}+E_{pot}\]
\[E_{kin}=\frac{1}{2}*m_e*v_n^2\]
\[E_{pot}=-\frac{1}{4*\pi*\epsilon_0}*\frac{e^2}{r_n}\]
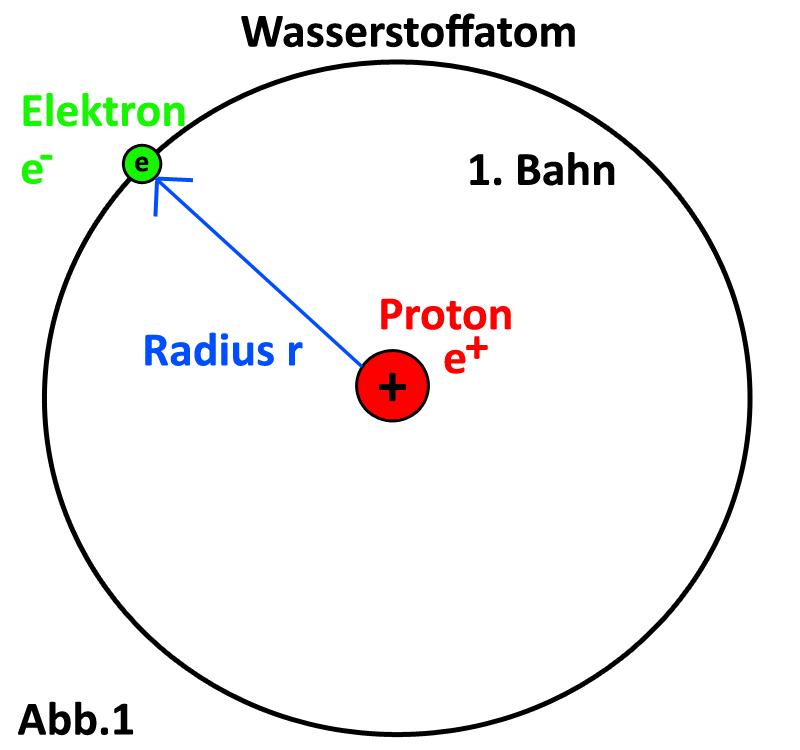
Die Coulombkraft, welche im Atom wirkt, ruft zusätzlich die die Zentralkraft hervor, wodurch die Kreisbahnbewegung zu stande kommt. Man kann diese beiden Kräfte also gleichsetzen: \[F_{zentri} = F_{coul}\] \[\Leftrightarrow \frac{m_e*v_n^2}{r_n}=\frac{1}{4*\pi*\epsilon_0}*\frac{e^2}{r_n^2} \qquad \mid *r_n^2\] \[\Leftrightarrow m_e*v_n^2*r_n=\frac{1}{4*\pi*\epsilon_0}*e^2 \qquad \mid L_n=n*\frac{h}{2*\pi}=m_e*v_n*r_n\] Wie zu sehen erhält man nach umformen der Gleichungen auf der linken Seite eine Formel, die für den Drehimpuls (L = r*me*v) steht. Diesen kann man nun einsetzten. \[\Leftrightarrow \frac{n*h}{2*\not{\pi}}*v_n=\frac{1}{4*\not{\pi}*\epsilon_0}*e^2 \qquad \mid :h,:n,-2\] Im Folgenden benutzt man das erste Bohrsche Postulat für den Drehimpuls und setzt anstatt des Drehimpulses n/(2π) ein und man erhält eine Formel für die Geschwindigkeit vn auf der n-ten Bahn: \[\Rightarrow v_n=\frac{e^2}{2*\epsilon_0*h}*\frac{1}{n}\] In die bekannte Bedingung für den Drehimpuls setzt man jetzt die gerade ermittelte Formel für vn ein und formt weiter um, sodass man eine Formel für rn erhält. \[Einsetzen \;\ von \;\ v_n \;\ in \;\ L_n:\] \[\Rightarrow \frac{m_e*r_n*e^2}{2*\epsilon_0*n*h}=\frac{n*h}{2*\pi}\] \[\Rightarrow r_n=\frac{h^2*\epsilon_0}{m_e*e^2*\pi}*n^2\] Hat man die Formeln für vn und rn, kann man diese in die erste Bedingung für die Enegien einsetzten und erhält so nach weitere Umformung eine Formel für die Energie auf der n-ten Bahn. Nach Ausrechnung der Konstate aus Masse, Ladung, elektrischer Feldkonstate und h aus, so ergibt sich folgende Formel für die Bahnen des Wasserstoffatoms. \[Einsetzen \;\ von \;\ v_n \;\ und \;\ r_n \;\ in \;\ E_{Ges}:\] \[E_{Ges}=\frac{1}{2}*m_e*v_n^2-\frac{1}{4*\pi*\epsilon_0}*\frac{e^2}{r_n}\] \[= \frac{1}{2}*m_e*(\frac{e^2}{2*\epsilon_0*h}*\frac{1}{n})^2-\frac{1}{4*\pi*\epsilon_0}*\frac{e^2}{(\frac{h^2*\epsilon_0}{m_e*e^2*\pi}*n^2)}\] \[=\frac{1}{8}*\frac{m_e*e^4}{\epsilon_0^2*h^2}*\frac{1}{n^2}-\frac{1}{4}*\frac{m_e*e^4}{\epsilon_0^2*h^2}*\frac{1}{n^2}\] \[\Rightarrow E_{Ges}=-\frac{1}{8}*\frac{m_e*e^4}{\epsilon_0^2*h^2}*\frac{1}{n^2}=-13,6eV*\frac{1}{n^2}\] Hinweis: Die Konstate auszurechnen ist gar nicht so einfach, da sehr hohe Exponenten auftauchen. Normale Schulrechner kommen mit unter ins Schwitzen, wenn man zuerst den Nenner ausrechnet und dann durch den Zähler teilt, da muss man den Bruch etwas splitten (probiert es mal aus).